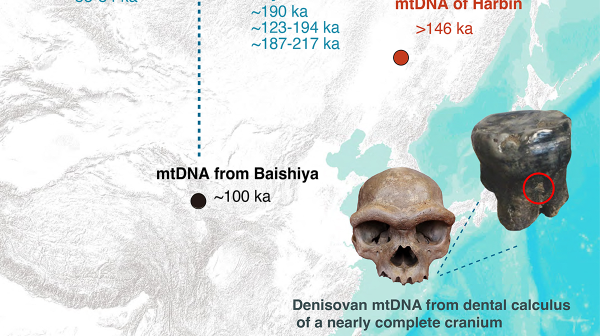
科技日報記者 金鳳 通訊員 吳涵玉
在生命起源的奧秘中,胚胎發育始終是深受關注的謎題之一。東南大學教授林承棋、羅卓娟、謝芃領銜多家科研機構在全球首次構建單細胞精度三維數字胚胎,并在其中發現中內胚層器官的原基決定區,“破譯”心臟發育密碼。這一發現不僅填補了哺乳動物心臟早期發育機制的理論空白,也為先天性心臟病防治及再生醫學發展提供關鍵理論基礎。相關研究成果18日發表在國際學術期刊《細胞》上。
“早期胚胎的細胞團里,藏著心臟、肺、肝臟等器官形成的關鍵細胞。”論文共同通訊作者林承棋介紹,哺乳類動物的胚胎經過原腸運動后,形成外、中、內3個胚層。經過生物體內復雜的信號通路調控,三胚層進一步形成各種器官原基,即器官的雛形。
長期以來,胚胎中胚層和內胚層器官原基的精確定位及形成機制一直是困擾學界百年的“世紀難題”。
此次研究中,科研團隊在全球首次構建了從小鼠原腸運動后期到心臟等器官原基形成期的單細胞精度三維數字胚胎,試圖了解器官特別是心臟的發育過程。
“我們建構了6個單細胞數字胚胎,每個胚胎細分為60個切片,累計解析數十萬個細胞的基因表達信息。”論文的共同第一作者謝芃介紹,為捕捉器官形成的動態過程,團隊在器官原基形成關鍵時期,對小鼠胚胎進行單細胞空間組學分析,如同給每個細胞裝上“GPS定位”,記錄其基因表達特征與空間位置。
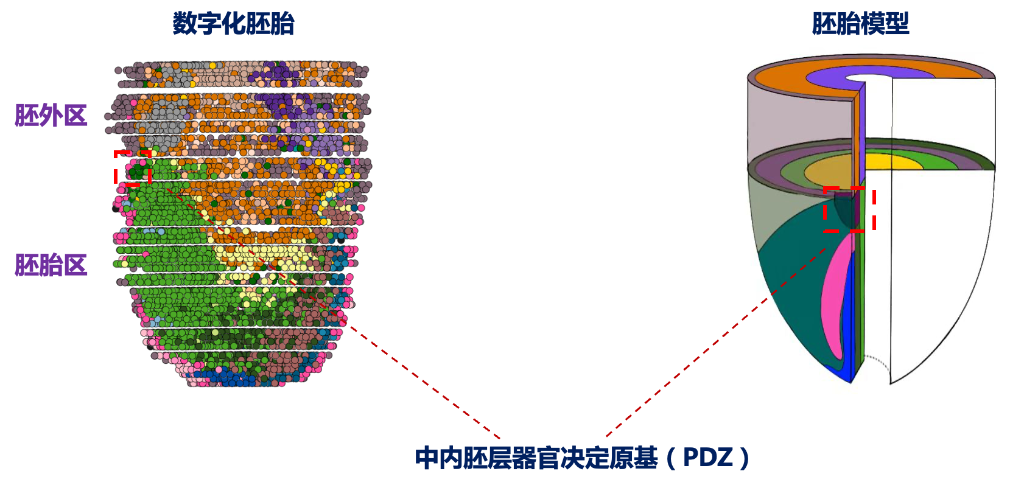
研究發現,在小鼠胚胎發育到7.75天時,胚內、胚外層交界處出現一個獨特的信號“洼地”——器官原基決定區(PDZ)。
“PDZ處于胚內層高濃度信號抑制分子與胚外層激活性配體分子的交界處,這里的信號活性偏低,但可以表達多種受體信號基因,容易接收多胚層信號的調控輸入,驅動心臟等器官原基協同發育的微環境。”林承棋說,此次研究首次揭示了PDZ可以通過整合無翅型相關整合位點、成纖維細胞生長因子、骨形態發生蛋白等通路,將微環境信號轉化為基因選擇性表達指令,驅動器官原基形成。
當前,我國出生缺陷發病率約5.6%,其中先天性心臟病是最為常見的出生缺陷類型。“PDZ的發現,為追溯心臟發育異常的起源提供了‘時空坐標’——在胚胎器官發育的關鍵窗口期,遺傳因素或環境因素對PDZ的干擾,可能導致器官原基形成異常。”論文共同通訊作者羅卓娟表示,通過數字胚胎技術,科學家能精準定位決定中內胚層器官命運的細胞群,進而研究基因突變或環境因素如何影響這一過程。